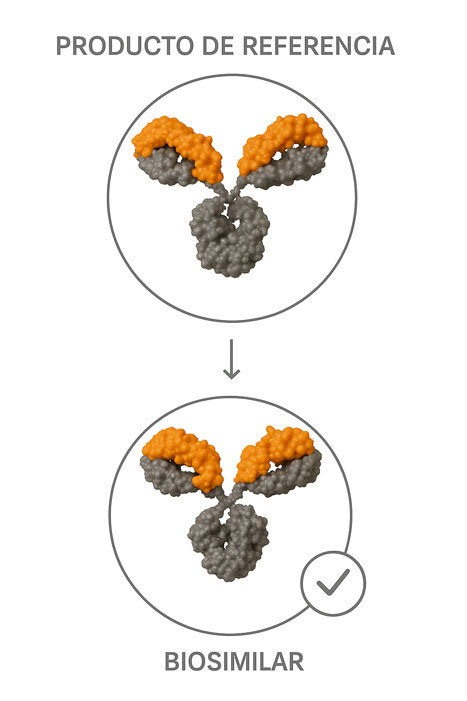
Un medicamento biosimilar es aquel que se ha desarrollado para ser altamente similar a su medicamento de referencia 10.
¿Qué son los medicamentos biológicos?
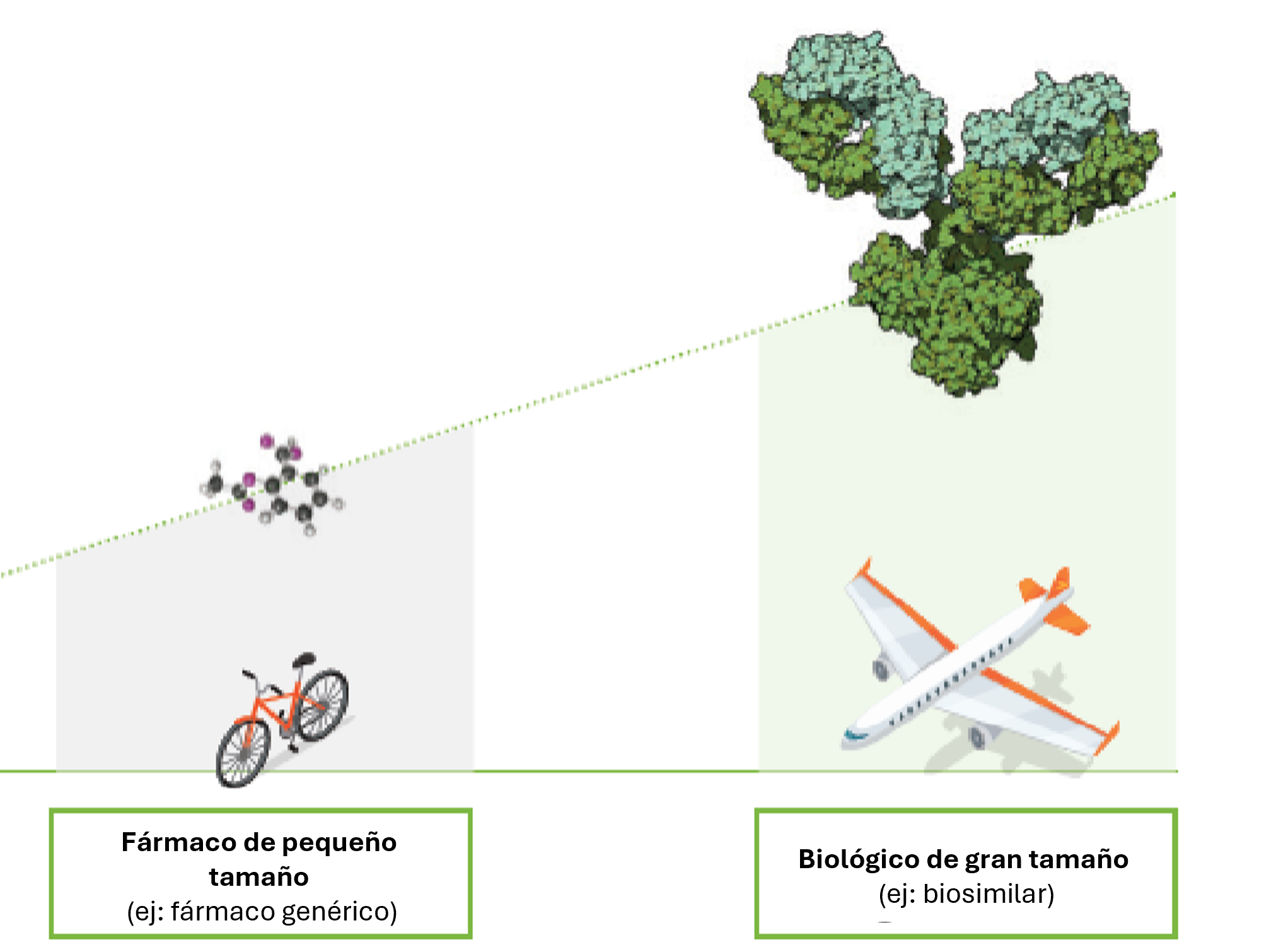
Un medicamento biológico es un fármaco que procede de organismos vivos (como células humanas, animales o microorganismos) 5,6.
Por su parte, un medicamento biosimilar es…
Un medicamento biológico con una estructura molecular, actividad farmacológica, eficacia y seguridad equivalentes a otro biológico, conocido como el medicamento de referencia 5,7,8.
Misma eficacia seguridad y calidad
Un biosimilar no es idéntico al biológico de referencia, ya que está sujeto a una variabilidad inherente a todo el proceso de producción en el que participan seres vivos 5,7,8.
Por eso, se consideran versiones altamente similares al de referencia con la misma eficacia, seguridad y calidad que el original, avaladas por estudios científicos y regulaciones estrictas 5,7,8,9.